- Главная
- Новости
Диагностика инфекционных причин репродуктивных патологий свиней
В.В. Пругло, к.в.н., руководитель отдела ветеринарного сервиса ООО Сева СА, член экспертно-консультационного совета по ветеринарии НСС
1. Введение
Репродуктивные патологии являются важнейшей причиной экономических потерь в промышленном свиноводствеi. Размеры убытков сильно варьируют в зависимости от охвата поголовья на ферме и распространённости патологий(болезни) в стаде: от единичных индивидуальных до массовых проявлений. К сожалению, во многих случаях диагностика не проводится, иногда наличие проблем игнорируется, а проблемные животные просто выбраковываются.
В связи с многообразием репродуктивных патологий, а также причин их возникновения, в данной статье будут рассмотрены лишь важнейшие и/или часто встречающиеся инфекции, вызывающие нарушения репродуктивных функций у свиней.
ВНИМАНИЕ: При анализе причин репродуктивных патологий необходим комплексный профессиональный подход, позволяющий поставить правильный диагноз и реализовать эффективные мероприятия. Комплексный подход подразумевает постановку предварительного диагноза с учётом:
1. Особенностей группы животных: ремонтные свинки, свиноматки, поросята, др.
2. Характера патологий: аборты, м/р и/или слабые поросята, мумификация, прохолост, др.
3. Охвата поголовья: единичные проявления, массовые
4. Периода возникновения патологий: сезонность, постоянство, др.
5. Изменений (ферма, стадо): микроклимат, содержание, кормление, поголовье, и т.п.
6. Изменений (обработки, вакцинации): схема, вакцины, антибиотики, др.
К сожалению, постановка окончательного диагноза и подтверждение инфекционной причины лабораторными методами, происходит не более чем в 25-35% случаевii, iii. Практически все такие случаи связаны с массовыми проявлениями репродуктивных патологий в результате инфицирования стада различными микроорганизмами. На основании этого у руководителей предприятий складывается ложное впечатление, что на промышленном комплексе (ферме) именно инфекционные болезни являются причиной проблем с репродукцией. Однако, большая часть (до 70%!) нарушений и патологий репродуктивных функций свиней обусловлена менеджментом, технологией, условиями содержания/кормления и другими неинфекционными причинами.
2. Схема диагностического процесса
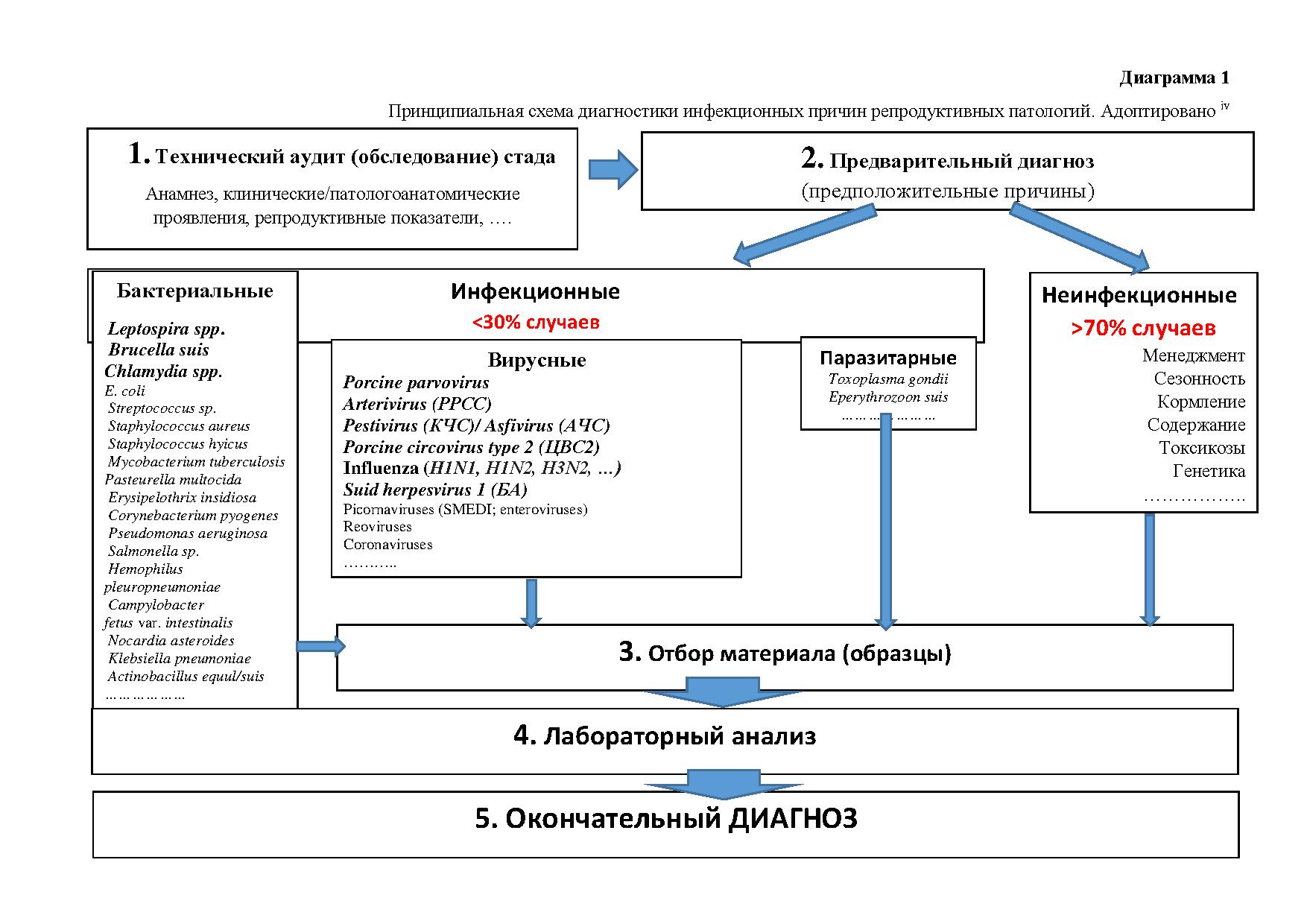
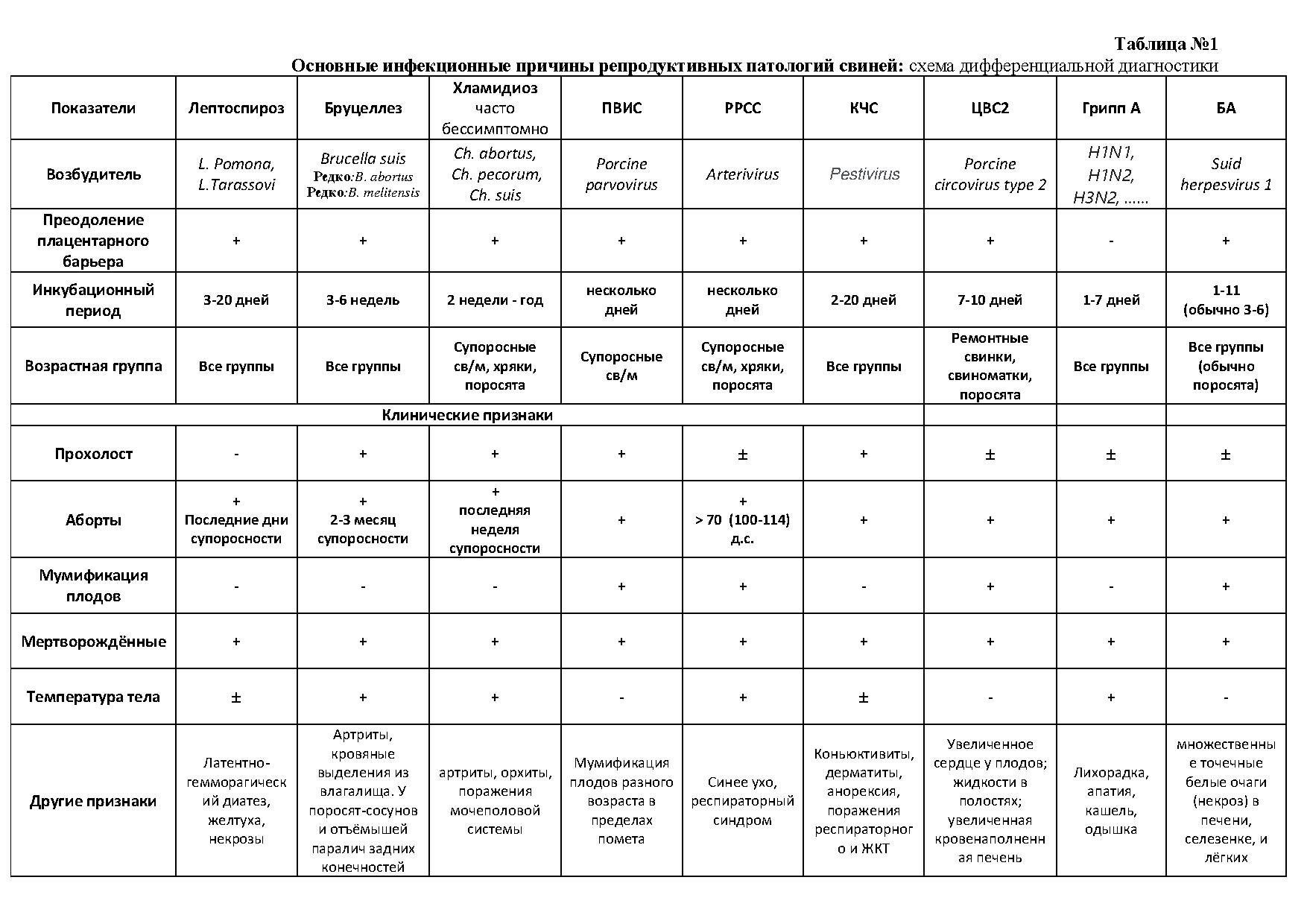
Принципиальная схема диагностического процесса инфекционных причин репродуктивных патологий приведена на Диаграмме 1.
1. Диагностика должна включать:
• Анализ истории проблемы (анамнез).
• Обследование (аудит) проблемных животных и отбор образцов.
• Лабораторное подтверждение/опровержение предварительного диагноза.
2.1. Обследование (технический аудит) группы свиней с предполагаемыми репродуктивными патологиями (клиническое, патологоанатомическое, эпизоотологическое) позволяет дифференцировать репродуктивную проблематику на:
• Острую/первичную (аборты, мумификация/мацерация плодов, мертворождённые, недоразвитые/слабые, др.).
• Хроническую (% прихода в охоту, % осеменения, %опороса, % прохолостов и т.п.).
Оба варианта могут быть связаны с различными причинами, однако при наличии хронических патологий жизненно необходимо проанализировать возможные неинфекционные причины. Напротив, первичный занос инфекции в стадо почти всегда вызывает острую вспышку с яркой клинической картиной: повышением температуры тела, отказ от корма, апатия и аборты. Наиболее значимые (основные) инфекционные агенты, вызывающие репродуктивные патологии и базовые критерии дифференциальной диагностики представлены в Таблице 1. Список возбудителей значительно обширнее, но вероятность выявления экзотических патогенов на промышленном предприятии в настоящее время минимальна.
Итогом обследования является предварительный диагноз, определяющий дальнейшие действия. В случае подозрения на инфекционную причину основании предварительного диагноза отбирают образцы для лабораторного исследования с учётом особенностей предполагаемого патогенного микроорганизма (тропизм/локализация, транспортировка, хранение) и планируемых методик исследования (серология, ПЦР, микробиология, др.).
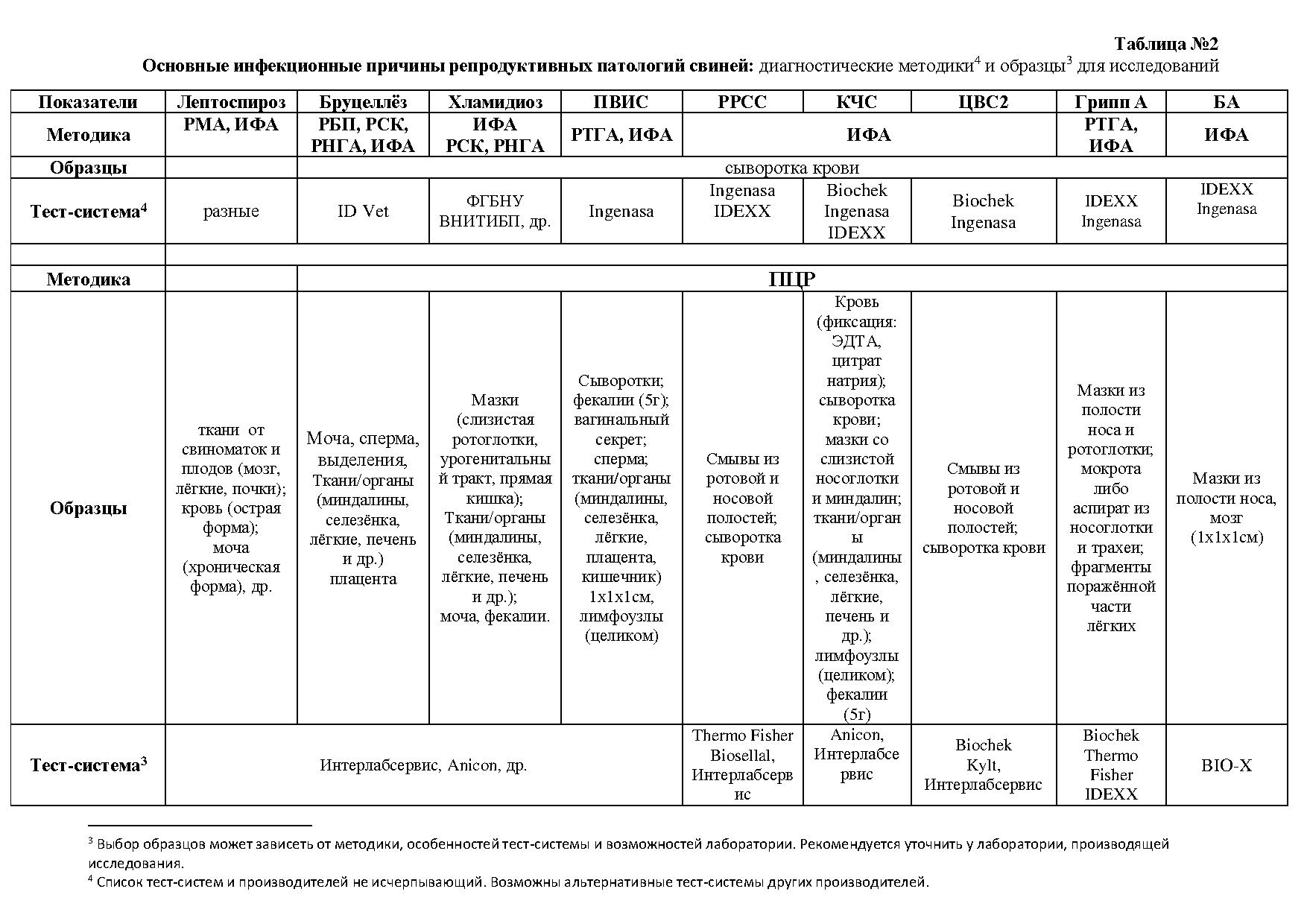
Методы лабораторных исследований и необходимые образцы для лабораторного обследования суммированы в Таблице 2.
2.2. Серологическое исследование
Сыворотки крови являются одним из лучших образцов для лабораторного исследования. Правильно полученный образец сыворотки может храниться/транспортироваться длительный период времени (месяцы, в замороженном состоянии) без угрозы потери достоверности.
В сыворотках можно обнаружить как самого возбудителя (антиген), так и специфические антитела, подтверждающие контакт животного с определённым микроорганизмом.
Важнейшими этапами серологических исследований являются:
2.2.1. Цели исследования (выявление антигенов и\или антител (IgG, IgM, др.).
2.2.2. Схемы отбора образцов. Наиболее актуальными являются:
• Парные пробы: последовательный отбор двух и более образцов от одного и того же животного. 1й отбор в момент острой болезни (24-48 ч начала клинических признаков. Например, аборта), 2й отбор через 3-4 недели. Количество объектов (свиней) варьирует от 5 до 15. Цель: оценка динамики специфических антител у заведомо больного животного. Повышение уровней специфических антител против определённого микроорганизма подтверждает его участие в данной патологии. В случае энзоотии (т.е. хронической субклинической инфекции на ферме) вероятность выявления увеличения антител в парных пробах снижается.
• Скрининг: одновременное обследование сывороток крови самых старших возрастных групп животных с целью выявления любых возможных контактов с важнейшими патогенами. Количество образцов 10-20/группу. При >25% распространённости инфекции в стаде, обследование такого количества сывороток обеспечивает 90-95% достоверность.
• Мониторинг: детальное обследование (формирование серопрофиля) по известной инфекции. Позволяет оценить динамику инфекционного процесса в стаде. Отбор образцов производят одномоментно от разных возрастных групп, с допущением, что каждая группа повторяет жизненный путь предыдущей.
2.2.3. Учёт особенностей целевого микроорганизма (биологические особенности, тропизм/локализацию в организме животного и период инфекционного процесса. Например, вирусы, вызывающие системную инфекцию (КЧС, ЦВС2, РРСС, БА, парвовирус, лептоспироз, бруцеллез) в период острой фазы болезни будут циркулировать в крови и вызывать виремию/бактериемию. Однако другие микроорганизмы невозможно обнаружить в крови в связи с их локальной репликацией (грипп, хламидии).
2.2.4. Учёт особенностей методик и тест-систем Исследования на наличие антител можно выполнять с различной целью, по разным схемам и с применением различных методик (РТГА, ИФА, ДР).
2.2.5. Правильная интерпретация полученных результатов.
2.3. Молекулярно-биологические исследование (ПЦР и др.)
Современный, удобный, точный метод исследования. Однако, как и любой другой имеет ограничения и недостатки. Материалом для исследования могут служить практически любые органы и ткани, а также смывы/мазки, выделения/жидкости, потенциально содержащие генетический материал целевых микроорганизмов.
Важнейшими этапами и ограничениями являются:
• Учёт особенностей целевого микроорганизма (быстрое разрушение генетического материала, тропизм/локализация, др.).
• Высокая чувствительность методики (угроза кросс-контаминации образцов).
• Учёт особенностей тест-систем (специфические стабилизаторы для цельной крови, биоматериал, др.).
2.4. Микробиологические исследование
Исследования включают выделение (изоляцию, культивирование) микроорганизма, изучение его морфологических (микроскопия), биохимических, патогенных и других особенностей/свойств. Позволяют типизировать микроорганизм и определить его чувствительность к антибактериальным препаратам.
Ограничениями являются:
• Особенности целевого микроорганизма (быстрая гибель, тропизм/локализация, др.).
• Кросс-контаминация образцов сапрофитной/секундарной микрофлорой.
• Предшествующие обработки антибактериальными препаратами.
3. Транспортировка образцов
Образцы биологического материала должны быть максимально быстро доставлены в лабораторию (на исследование). После отбора образцы рекомендуется охладить до 2-8°С и транспортировать не более 48 ч. При более длительной транспортировке возможна консервация холодом (заморозка).
ВНИМАНИЕ: Заморозка образцов биоматериала нежелательна при бактериологических исследованиях.
Для минимизации повреждений образцов и исключения лабораторных ошибок, также используют специализированные системы (например, вакуумные пробирки) для отбора сыворотки/крови и транспортные среды.
ВНИМАНИЕ: Выбор системы отбора образца и транспортных сред зависит от целей и методик, планируемых исследований.
3.1. Вакуумные пробирки с различными наполнителями (консервантами)
3.1.1. Получение сыворотки: для ускорения свёртывания крови используется активатор образования сгустка (SiO2-диоксид кремния, также называется, clot-activator, АС, кремнезем), который обеспечивает разделение сыворотки и сгустка до 48 ч без повторного центрифугирования. Система используется для сбора материала и анализа биохимии, серологии, бактериологии.
3.1.2. Получение цельной (стабилизированной) крови: могут использоваться различные стабилизаторы (гепарин, цитрат натрия, ЭДТА, др.). Системы используются для сбора материала и анализа молекулярно-биологических исследований, гематологии, биохимии, серологии, иммунологии и др.
3.2. Транспортные среды (ТС).
Транспортные среды необходимы для максимального сохранения биоматериала на пути от пациента до исследования. Детальные рекомендации по выбору транспортной среды для биоматериала из урогенитального тракта (мазки, соскобы), с учётом планируемых исследований (инфекций и методики), можно найти у производителей тест-систем (например, Интерлабсервис (https://www.interlabservice.ru/catalog/reagents/?sid=1179) или непосредственно у лаборатории, проводящей исследования.
1. Введение
Репродуктивные патологии являются важнейшей причиной экономических потерь в промышленном свиноводствеi. Размеры убытков сильно варьируют в зависимости от охвата поголовья на ферме и распространённости патологий(болезни) в стаде: от единичных индивидуальных до массовых проявлений. К сожалению, во многих случаях диагностика не проводится, иногда наличие проблем игнорируется, а проблемные животные просто выбраковываются.
В связи с многообразием репродуктивных патологий, а также причин их возникновения, в данной статье будут рассмотрены лишь важнейшие и/или часто встречающиеся инфекции, вызывающие нарушения репродуктивных функций у свиней.
ВНИМАНИЕ: При анализе причин репродуктивных патологий необходим комплексный профессиональный подход, позволяющий поставить правильный диагноз и реализовать эффективные мероприятия. Комплексный подход подразумевает постановку предварительного диагноза с учётом:
1. Особенностей группы животных: ремонтные свинки, свиноматки, поросята, др.
2. Характера патологий: аборты, м/р и/или слабые поросята, мумификация, прохолост, др.
3. Охвата поголовья: единичные проявления, массовые
4. Периода возникновения патологий: сезонность, постоянство, др.
5. Изменений (ферма, стадо): микроклимат, содержание, кормление, поголовье, и т.п.
6. Изменений (обработки, вакцинации): схема, вакцины, антибиотики, др.
К сожалению, постановка окончательного диагноза и подтверждение инфекционной причины лабораторными методами, происходит не более чем в 25-35% случаевii, iii. Практически все такие случаи связаны с массовыми проявлениями репродуктивных патологий в результате инфицирования стада различными микроорганизмами. На основании этого у руководителей предприятий складывается ложное впечатление, что на промышленном комплексе (ферме) именно инфекционные болезни являются причиной проблем с репродукцией. Однако, большая часть (до 70%!) нарушений и патологий репродуктивных функций свиней обусловлена менеджментом, технологией, условиями содержания/кормления и другими неинфекционными причинами.
2. Схема диагностического процесса
Принципиальная схема диагностического процесса инфекционных причин репродуктивных патологий приведена на Диаграмме 1.
1. Диагностика должна включать:
• Анализ истории проблемы (анамнез).
• Обследование (аудит) проблемных животных и отбор образцов.
• Лабораторное подтверждение/опровержение предварительного диагноза.
2.1. Обследование (технический аудит) группы свиней с предполагаемыми репродуктивными патологиями (клиническое, патологоанатомическое, эпизоотологическое) позволяет дифференцировать репродуктивную проблематику на:
• Острую/первичную (аборты, мумификация/мацерация плодов, мертворождённые, недоразвитые/слабые, др.).
• Хроническую (% прихода в охоту, % осеменения, %опороса, % прохолостов и т.п.).
Оба варианта могут быть связаны с различными причинами, однако при наличии хронических патологий жизненно необходимо проанализировать возможные неинфекционные причины. Напротив, первичный занос инфекции в стадо почти всегда вызывает острую вспышку с яркой клинической картиной: повышением температуры тела, отказ от корма, апатия и аборты. Наиболее значимые (основные) инфекционные агенты, вызывающие репродуктивные патологии и базовые критерии дифференциальной диагностики представлены в Таблице 1. Список возбудителей значительно обширнее, но вероятность выявления экзотических патогенов на промышленном предприятии в настоящее время минимальна.
Итогом обследования является предварительный диагноз, определяющий дальнейшие действия. В случае подозрения на инфекционную причину основании предварительного диагноза отбирают образцы для лабораторного исследования с учётом особенностей предполагаемого патогенного микроорганизма (тропизм/локализация, транспортировка, хранение) и планируемых методик исследования (серология, ПЦР, микробиология, др.).
Методы лабораторных исследований и необходимые образцы для лабораторного обследования суммированы в Таблице 2.
2.2. Серологическое исследование
Сыворотки крови являются одним из лучших образцов для лабораторного исследования. Правильно полученный образец сыворотки может храниться/транспортироваться длительный период времени (месяцы, в замороженном состоянии) без угрозы потери достоверности.
В сыворотках можно обнаружить как самого возбудителя (антиген), так и специфические антитела, подтверждающие контакт животного с определённым микроорганизмом.
Важнейшими этапами серологических исследований являются:
2.2.1. Цели исследования (выявление антигенов и\или антител (IgG, IgM, др.).
2.2.2. Схемы отбора образцов. Наиболее актуальными являются:
• Парные пробы: последовательный отбор двух и более образцов от одного и того же животного. 1й отбор в момент острой болезни (24-48 ч начала клинических признаков. Например, аборта), 2й отбор через 3-4 недели. Количество объектов (свиней) варьирует от 5 до 15. Цель: оценка динамики специфических антител у заведомо больного животного. Повышение уровней специфических антител против определённого микроорганизма подтверждает его участие в данной патологии. В случае энзоотии (т.е. хронической субклинической инфекции на ферме) вероятность выявления увеличения антител в парных пробах снижается.
• Скрининг: одновременное обследование сывороток крови самых старших возрастных групп животных с целью выявления любых возможных контактов с важнейшими патогенами. Количество образцов 10-20/группу. При >25% распространённости инфекции в стаде, обследование такого количества сывороток обеспечивает 90-95% достоверность.
• Мониторинг: детальное обследование (формирование серопрофиля) по известной инфекции. Позволяет оценить динамику инфекционного процесса в стаде. Отбор образцов производят одномоментно от разных возрастных групп, с допущением, что каждая группа повторяет жизненный путь предыдущей.
2.2.3. Учёт особенностей целевого микроорганизма (биологические особенности, тропизм/локализацию в организме животного и период инфекционного процесса. Например, вирусы, вызывающие системную инфекцию (КЧС, ЦВС2, РРСС, БА, парвовирус, лептоспироз, бруцеллез) в период острой фазы болезни будут циркулировать в крови и вызывать виремию/бактериемию. Однако другие микроорганизмы невозможно обнаружить в крови в связи с их локальной репликацией (грипп, хламидии).
2.2.4. Учёт особенностей методик и тест-систем Исследования на наличие антител можно выполнять с различной целью, по разным схемам и с применением различных методик (РТГА, ИФА, ДР).
2.2.5. Правильная интерпретация полученных результатов.
2.3. Молекулярно-биологические исследование (ПЦР и др.)
Современный, удобный, точный метод исследования. Однако, как и любой другой имеет ограничения и недостатки. Материалом для исследования могут служить практически любые органы и ткани, а также смывы/мазки, выделения/жидкости, потенциально содержащие генетический материал целевых микроорганизмов.
Важнейшими этапами и ограничениями являются:
• Учёт особенностей целевого микроорганизма (быстрое разрушение генетического материала, тропизм/локализация, др.).
• Высокая чувствительность методики (угроза кросс-контаминации образцов).
• Учёт особенностей тест-систем (специфические стабилизаторы для цельной крови, биоматериал, др.).
2.4. Микробиологические исследование
Исследования включают выделение (изоляцию, культивирование) микроорганизма, изучение его морфологических (микроскопия), биохимических, патогенных и других особенностей/свойств. Позволяют типизировать микроорганизм и определить его чувствительность к антибактериальным препаратам.
Ограничениями являются:
• Особенности целевого микроорганизма (быстрая гибель, тропизм/локализация, др.).
• Кросс-контаминация образцов сапрофитной/секундарной микрофлорой.
• Предшествующие обработки антибактериальными препаратами.
3. Транспортировка образцов
Образцы биологического материала должны быть максимально быстро доставлены в лабораторию (на исследование). После отбора образцы рекомендуется охладить до 2-8°С и транспортировать не более 48 ч. При более длительной транспортировке возможна консервация холодом (заморозка).
ВНИМАНИЕ: Заморозка образцов биоматериала нежелательна при бактериологических исследованиях.
Для минимизации повреждений образцов и исключения лабораторных ошибок, также используют специализированные системы (например, вакуумные пробирки) для отбора сыворотки/крови и транспортные среды.
ВНИМАНИЕ: Выбор системы отбора образца и транспортных сред зависит от целей и методик, планируемых исследований.
3.1. Вакуумные пробирки с различными наполнителями (консервантами)
3.1.1. Получение сыворотки: для ускорения свёртывания крови используется активатор образования сгустка (SiO2-диоксид кремния, также называется, clot-activator, АС, кремнезем), который обеспечивает разделение сыворотки и сгустка до 48 ч без повторного центрифугирования. Система используется для сбора материала и анализа биохимии, серологии, бактериологии.
3.1.2. Получение цельной (стабилизированной) крови: могут использоваться различные стабилизаторы (гепарин, цитрат натрия, ЭДТА, др.). Системы используются для сбора материала и анализа молекулярно-биологических исследований, гематологии, биохимии, серологии, иммунологии и др.
3.2. Транспортные среды (ТС).
Транспортные среды необходимы для максимального сохранения биоматериала на пути от пациента до исследования. Детальные рекомендации по выбору транспортной среды для биоматериала из урогенитального тракта (мазки, соскобы), с учётом планируемых исследований (инфекций и методики), можно найти у производителей тест-систем (например, Интерлабсервис (https://www.interlabservice.ru/catalog/reagents/?sid=1179) или непосредственно у лаборатории, проводящей исследования.
3.2.1. ТС для вирусологических и молекулярно-биологических исследований.
Входящий в состав транспортных сред стабилизатор препятствует разрушению микроорганизмов-возбудителей инфекционных болезней, сохраняя их генетический материал. Консервант препятствует развитию сапрофитной бактериальной микрофлоры в образце. Также консервант фиксирует микроорганизмы в том качественном и количественном составе, в котором они присутствовали в момент отбора, что обеспечивает объективные результаты количественных исследований. Хорошим вариантом является использование универсальной транспортной среды (Фото-пример 1), позволяющая использовать различные методики исследований:
• Культуральный (вирусы, хламидии, микоплазмы).
• Иммуноферментный анализ (ИФА).
• Молекулярно-биологические (ПЦР, сиквенс, др.).
Фото-пример 1
Универсальная среда для сбора, транспортировки и хранения (заморозка) вирусов, хламидий, микоплазм
Фото-пример 2
Универсальная система для сбора, транспортировки и поддержания жизнедеятельности аэробных, анаэробных и прихотливых микроорганизмов (http://danies.ru/products/universalnaja_sistema_eswab_na_osnove_zhidkoi_transportnoi_sredy/)
3.2.2. ТС для бактериологических исследований.
ВНИМАНИЕ: не следует использовать для бактериологических исследований ТС, предназначенные для вирусологических и молекулярно-биологических исследований!
Для бактериологических исследований применяют различные виды транспортных сред.
Наиболее применяемыми на практике являются следующие ТС (Фото-пример 2):
• Амиес (с углём и без): выделение аэробных и анаэробных, а также прихотливых микроорганизмов из респираторного тракта, влагалища и раневого содержимого.
• Кари-Блэйра: выделение аэробных и анаэробных, а также прихотливых микроорганизмов из фекалий.
• Стюарта: хранения и транспортировки прихотливых микроорганизмов.

4. Заключение
4.1. Первый этап профилактики/лечения – обследование (животного/группы/стада) и формирование предварительного диагноза.
4.2. Правильный отбор образца (место, время, количество), его транспортировка и хранение – залог достоверного исследования.
4.3. Интерпретация и анализ всей доступной информации - окончательный диагноз(ы).
4.4. Стратегия решения проблемы: корректировки (менеджмента, содержания/кормления, профилактики, лечения, и/или др.).
Литература
i W.L. Schwartz Laboratory Diagnosis of Swine Diseases Vet Clin North Am Large Anim Pract. 1982 Nov; 4(2): 201–223. Published online 2017 Jul 20 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7172716/
ii Kirkbride, C. A.: Diagnostic studies on porcine abortions. In Lucas, L. E., and Wagner, W. C. (eds.): Effect of Disease and Stress on Reproductive Efficiency in Swine. Symposium Proceedings, National Pork Producer’s Council, Federal Extension Service, University of Nebraska Extension Service, Iowa State University Veterinary Medical Research Institute and Agricultural Research Service, United States Department of Agriculture, 1970.
iii Schwartz, W. L.: 1980 Swine health problems diagnosed by the Texas Veterinary Diagnostic Laboratory. In Proceedings of the Swine Short Course, Texas Agricultural Conference, 1981.
14.09.2021
1824