Авторы: Малков М.А., Богомолов В.В., Данькова Т.В., Краснов К.А.
ЗАО «НПФ «ЭЛЕСТ», ФГУ Облветлаборатория, (Санкт-Петербург)
В первой части статьи были приведены данные по сорбции шести токсинов нейтрализаторами различного состава в системе корм-сорбент-токсин. Было показано, что при норме ввода 0,2% роль сорбентов нивелирована в значительной степени, поскольку большая часть токсинов сорбируется на субстраты корма. Мы предложили осуществлять постоянный контроль за концентрацией токсинов в кормах и при концентрации на уровне МДУ и выше увеличивать временно норму ввода до 1%.
Тем не менее ситуация в кишечнике остается неясной. Понятно, что оптимальное решение – когда в кишечнике создается минимальная концентрация токсинов, частично попадающая в кровь и подвергающаяся дезактивации в печени. Однако, в реальной ситуации мы показали, что для многих токсинов сорбционные связи оказываются нестойкими и они десорбируются при рН 7,2. В тоже время в кишечнике возрастает концентрация токсинов, поступающих из разрушающихся субстратов корма. Часть этих токсинов могут, по-видимому, связываться со свободными центрами сорбентов, образовывать комплексы с металлами, разрушаться кишечной микрофлорой. В этой связи нам представлялось интересным оценить способность к сорбции токсинов в щелочной области для различных нейтрализаторов с известным сорбционным составом и отдельных сорбентов. Поиск сорбентов, активно связывающих токсины в щелочной области рН, либо сорбентов, обладающих такой способностью и в кислой и щелочной зонах (желудок и кишечник) представляется одной из перспективных задач.
Материалы и методы
1 вариант:
Абсорбцию измеряют по утвержденной методике при постановке теста In vitro.
1. В колбу наливают 100 см3 жидкости, имитирующей желудочный сок (водный раствор соляной кислоты с рН=1,2);
2. Вносят рассчитанное количество микотоксина, добавляют исследуемый сорбент и тщательно перемешивают;
3. Выдерживают при постоянном перемешивании (с помощью магнитной мешалки) 1 час при температуре 37°С. Тем самым, моделируется время нахождения корма и рН в желудке;
4. Отделяют методом декантации надосадочную жидкость от осадка;
5. Экстракт (вытяжку) из микотоксинов - надосадочную жидкость исследуют на содержание микотоксина методом ИФА;
Таким образом, получают величину абсорбции - общее количество токсинов, связанных сорбентом за время нахождения корма в желудке,
равную разнице между количеством токсина в контрольной пробе (без добавки сорбента) и количеством свободного токсина в растворе после инкубации в кислом растворе вместе с сорбентом.
2 вариант:
1. В колбу наливают 100 см3 жидкости, имитирующей кишечный сок (буфер PBS с рн=7,4);
2. Вносят рассчитанное количество микотоксина, добавляют исследуемый сорбент и тщательно перемешивают;
3. Выдерживают при постоянном перемешивании (с помощью магнитной
мешалки) 1 час при температуре 37°С. Тем самым, моделируются рН и время
нахождения корма в проксимальном отделе кишечника, при котором
возможна эффективная сорбция микотоксинов перед поступлением в
кровь животного;
4. Методом декантации отделяют надосадочную жидкость от осадка;
5. Экстракт (вытяжку) из микотоксинов - надосадочную жидкость исследуют на содержание микотоксина методом ИФА;
Таким образом, получают величину
адсорбции - общее количество токсинов, связанных сорбентом за время нахождения корма в кишечнике, равную разнице между количеством токсина в контрольной пробе (без добавки сорбента) и количеством свободного токсина в растворе после инкубации в щелочном растворе вместе с сорбентом.
Результаты и их обсуждение
Таблица № 1. Адсорбция Афлатоксина В1 (МДУ= 50 мкг/кг).
|
№ п/п |
Сорбент |
Адсорбция в кислой среде |
Адсорбция в слабо-щелочной среде | ||
|
в мкг/кг |
в % |
в мкг/кг |
в % | ||
|
1 |
№1 Фунгистат – алюмосиликаты+бентониты+органические кислоты+гепатостимуляторы+протеолитический комплекс+фунгистатики+нуклеозиды |
30,5 |
60,9 |
33 |
65,8 |
|
2 |
№2 - неорганический сорбент (специальным образом обработанные цеолиты) +биотрансформирующий фермент |
11,2 |
22,3 |
20,8 |
41,5 |
|
3 |
№3 - смесь из адсорбентов + дрожжи+ соли пропионовой кислоты |
0 |
0 |
39,2 |
78,4 |
|
4 |
№4 - сорбент органической природы (полисахариды) |
0 |
0 |
30,6 |
61 |
|
5 |
№5 – бентониты+ дрожжи+ полисахариды растительного происхождения |
9,0 |
17,9 |
22,0 |
44 |
|
6 |
№6 - глинистые субстанции+ продукты переработки дрожжей+ органические кислоты+ антиоксиданты+ растительные экстракты |
4,2 |
8,4 |
30,0 |
60 |
|
7 |
№7 - модифицированные бентониты, минералы, силикаты, хелаты |
1,9 |
3,8 |
3,7 |
7,4 |
|
8 |
№8 - клиноплитонит, природный минерал, специальным образом обработанный |
9,7 |
19,3 |
6,6 |
13,2 |
Таблица № 2. Адсорбция Охратоксина (суммарно). (МДУ=50 мкг/кг).
|
№ п/п |
Сорбент |
Адсорбция в кислой среде |
Адсорбция в слабо-щелочной среде | ||
|
в мкг/кг |
в % |
в мкг/кг |
в % | ||
|
1 |
№1 Фунгистат – алюмосиликаты+бентониты+органические кислоты+гепатостимуляторы+протеолитический комплекс+фунгистатики+нуклеозиды |
19,0 |
38 |
17,7 |
35 |
|
2 |
№2 - неорганический сорбент (специальным образом обработанные цеолиты) +биотрансформирующий фермент |
37,5 |
75 |
17,4 |
34,9 |
|
3 |
№3 - смесь из адсорбентов + дрожжи+ соли пропионовой кислоты |
17,9 |
35,7 |
24,4 |
48,8 |
|
4 |
№4 - сорбент органической природы (полисахариды) |
0 |
0 |
29,0 |
58,1 |
|
5 |
№5 – бентониты+ дрожжи+ полисахариды растительного происхождения |
0 |
0 |
25,6 |
51,2 |
|
6 |
№6 - глинистые субстанции+ продукты переработки дрожжей+ органические кислоты+ антиоксиданты+ растительные экстракты |
0 |
0 |
26,7 |
53,5 |
|
7 |
№7 - модифицированные бентониты, минералы, силикаты, хелаты |
22,5 |
44,9 |
33,7 |
67,4 |
|
8 |
№8 - клиноплитонит, природный минерал, специальным образом обработанный |
0 |
0 |
33,7 |
67,4 |
Таблица № 3. Адсорбция Т-2 токсина. (МДУ=100 мкг/кг).
|
№ п/п |
Сорбент |
Адсорбция в кислой среде |
Адсорбция в слабо-щелочной среде | ||
|
в мкг/кг |
в % |
в мкг/кг |
в % | ||
|
1 |
№1 Фунгистат – алюмосиликаты+бентониты+органические кислоты+гепатостимуляторы+протеолитический комплекс+фунгистатики+нуклеозиды |
6,4 |
6,4 |
4,13 |
4,13 |
|
2 |
№2 - неорганический сорбент (специальным образом обработанные цеолиты) +биотрансформирующий фермент |
0 |
0 |
0 |
0 |
|
3 |
№3 - смесь из адсорбентов + дрожжи+ соли пропионовой кислоты |
0 |
0 |
0 |
0 |
|
4 |
№4 - сорбент органической природы (полисахариды) |
0 |
0 |
0 |
0 |
|
5 |
№5 – бентониты+ дрожжи+ полисахариды растительного происхождения |
0 |
0 |
0 |
0 |
|
6 |
№6 - глинистые субстанции+ продукты переработки дрожжей+ органические кислоты+ антиоксиданты+ растительные экстракты |
0 |
0 |
0 |
0 |
|
7 |
№7 - модифицированные бентониты, минералы, силикаты, хелаты |
2,2 |
2,2 |
0 |
0 |
|
8 |
№8 - клиноплитонит, природный минерал, специальным образом обработанный |
0 |
0 |
0 |
0 |
Таблица № 4. Адсорбция Дезоксинивалинола (ДОНа). (МДУ=1000 мкг/кг)
|
№ п/п |
Сорбент |
Адсорбция в кислой среде |
Адсорбция в слабо-щелочной среде | ||
|
в мкг/кг |
в % |
в мкг/кг |
в % | ||
|
1 |
№1 Фунгистат – алюмосиликаты+бентониты+органические кислоты+гепатостимуляторы+протеолитический комплекс+фунгистатики+нуклеозиды |
377 |
37,7 |
0 |
0 |
|
2 |
№2 - неорганический сорбент (специальным образом обработанные цеолиты) +биотрансформирующий фермент |
220 |
2,2 |
0 |
0 |
|
3 |
№3 - смесь из адсорбентов + дрожжи+ соли пропионовой кислоты |
202 |
20,2 |
0 |
0 |
|
4 |
№4 - сорбент органической природы (полисахариды) |
136 |
13,6 |
0 |
0 |
|
5 |
№5 – бентониты+ дрожжи+ полисахариды растительного происхождения |
197 |
19,7 |
0 |
0 |
|
6 |
№6 - глинистые субстанции+ продукты переработки дрожжей+ органические кислоты+ антиоксиданты+ растительные экстракты |
272 |
27,2 |
0 |
0 |
|
7 |
№7 - модифицированные бентониты, минералы, силикаты, хелаты |
474 |
47,4 |
0 |
0 |
|
8 |
№8 - клиноплитонит, природный минерал, специальным образом обработанный |
237 |
23,7 |
0 |
0 |
Таблица № 5. Адсорбция Зеараленона (F2). (МДУ=1000 мкг/кг)
|
№ п/п |
Сорбент |
Адсорбция в кислой среде |
Адсорбция в слабо-щелочной среде | ||
|
в мкг/кг |
в % |
в мкг/кг |
в % | ||
|
1 |
№1 Фунгистат – алюмосиликаты+бентониты+органические кислоты+гепатостимуляторы+протеолитический комплекс+фунгистатики+нуклеозиды |
813,0 |
81,0 |
0 |
0 |
|
2 |
№2 - неорганический сорбент (специальным образом обработанные цеолиты) +биотрансформирующий фермент |
713 |
71,0 |
307 |
30,7 |
|
3 |
№3 - смесь из адсорбентов + дрожжи+ соли пропионовой кислоты |
710,0 |
71,0 |
84,0 |
8,4 |
|
4 |
№4 - сорбент органической природы (полисахариды) |
746,0 |
74,6 |
390,0 |
39,0 |
|
5 |
№5 – бентониты+ дрожжи+ полисахариды растительного происхождения |
740,0 |
74,0 |
585,0 |
58,5 |
|
6 |
№6 - глинистые субстанции+ продукты переработки дрожжей+ органические кислоты+ антиоксиданты+ растительные экстракты |
790,0 |
79,0 |
496,0 |
49,6 |
|
7 |
№7 - модифицированные бентониты, минералы, силикаты, хелаты |
792,0 |
79,2 |
439,0 |
43,9 |
|
8 |
№8 - клиноплитонит, природный минерал, специальным образом обработанный |
800,0 |
80,0 |
494,0 |
49,4 |
Таблица 6. Эффективность обеззараживания “Фунгистатом” комбикорма, естественным образом контаминированного зеараленоном.
|
Концентрация “Фунгистата”, в г/кг корма |
Адсорбция зеараленона | |
|
в мкг/кг |
в% | |
|
5 (0,5%) |
0 |
0 |
|
10 (1%) |
2494,8 |
78,2 |
|
20 (2%) |
3166 |
100 |
Таблица № 7. Адсорбция Фумонизина (суммарно). (МДУ= 5000 мкг/кг).
|
№ п/п |
Сорбент |
Адсорбция в кислой среде |
Адсорбция в слабо-щелочной среде | ||
|
в мкг/кг |
в % |
в мкг/кг |
в % | ||
|
1 |
№1 Фунгистат – алюмосиликаты+бентониты+органические кислоты+гепатостимуляторы+протеолитический комплекс+фунгистатики+нуклеозиды |
4,89 |
97,8 |
0 |
0 |
|
2 |
№2 - неорганический сорбент (специальным образом обработанные цеолиты) +биотрансформирующий фермент |
4,62 |
92,4 |
0 |
0 |
|
3 |
№3 - смесь из адсорбентов + дрожжи+ соли пропионовой кислоты |
4,58 |
91,6 |
0 |
0 |
|
4 |
№4 - сорбент органической природы (полисахариды) |
4,75 |
95,0 |
0 |
0 |
|
5 |
№5 – бентониты+ дрожжи+ полисахариды растительного происхождения |
4,49 |
89,8 |
0 |
0 |
|
6 |
№6 - глинистые субстанции+ продукты переработки дрожжей+ органические кислоты+ антиоксиданты+ растительные экстракты |
4,52 |
90,3 |
0 |
0 |
|
7 |
№7 - модифицированные бентониты, минералы, силикаты, хелаты |
4,84 |
96,7 |
0 |
0 |
|
8 |
№8 - клиноплитонит, природный минерал, специальным образом обработанный |
4,72 |
94,4 |
0 |
0 |
В табл. 1-7 приведены результаты исследований сорбционной способности различных сорбентов, представленных в составе наиболее эффективных нейтрализаторов токсинов. В данном случае конкурентный фон в виде субстратов корма отсутствовал, т.е. в модельных опытах были изучены сорбенты различной природы в «чистом виде» в кислой и щелочной зонах. В предыдущем исследовании (Часть I статьи рис.1 «Технология животноводства» № ) было показано, что в условиях конкурентности с субстратами корма данные по сорбции токсинов различными нейтрализаторами очень близки, за отдельными исключениями. Несмотря на очевидную разницу в составе сорбентов у нейтрализаторов токсинов исключение составляют зеараленон и фумонизин. Как мы видели, связывание таких микотоксинов, как Афлатоксин, Т-2 токсин, Дон и охратоксин субстратами корма является определяющим и по сути не важно, какой именно нейтрализатор токсинов вводится в эту систему при норме 0,2%. Удержание этих токсинов на субстратах корма осуществляется, по-видимому, за счет Ван-дер-Ваальсовых взаимодействий, но не за счет специфического связывания. В силу своей химической структуры первые три токсина вообще не склонны к комплексообразованию. Для охратоксина в принципе можно подобрать комплексообразующий реагент, но судя по нашим данным, ни один из компонентов кормовой смеси и ни один из сорбентов не комплексует охратоксин. Напротив, зеараленон и фумонинин весьма склонны к образованию комплексов с рядом компонентов металлов. Такими металлами могут быть алюминий, железо, медь, переходные металлы. Точный состав сорбентов и кормовой смеси неизвестен, но алюминий во всех исследованных сорбентах присутствует (алюмосиликат, бентонит, глины и др.), встречается медь, железо. Результаты, полученные нами, свидетельствуют о необратимой и высокой сорбции указанных токсинов всеми нейтрализаторами, что связано с их комплексообразованием.
Иная картина наблюдается в неконкурентных условиях (таб. 1-7). Прежде всего, мы видим, что ряд сорбентов не обладают способностью к связыванию токсинов в слабо-щелочной среде (условия кишечника).
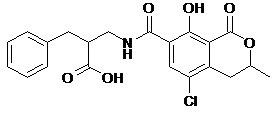
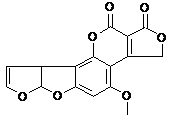
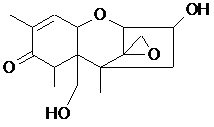
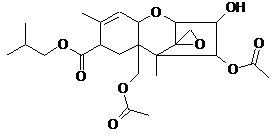
В этой области с сорбентами не связывается Дон, Фумонизин и Т-2 токсин (в этом случае «работает только «Фунгистат» в некоторой степени – 4,2%). Чем объяснить крайне низкую сорбцию Т-2 токсина для разных сорбентов? При рассмотрении структур 6ти токсинов можно отметить следующее (формулы рис. 1):
Рис.1
Охратоксин
Афлатоксин В1А
Дезоксиниваленол (ДОН)
Т-2 Токсин
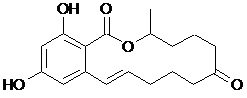
Зеараленон
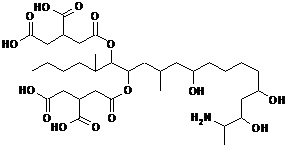
Фумонизин
Охратоксин, зеараленон и фумонинзин довольно полярны и содержат протонодонорные функции, благодаря чему склонны к связыванию с полярными сорбентами (окись алюминия, алюмосиликаты, кремнензем и др.). Афлотоксин гораздо менее полярен, но обладает плоской сопряженной системой, способной к связыванию на сорбентах и компонентах кормовой смеси за счет дисперсионных π-π взаимодействий. Хуже связываются Дон и Т-2 токсин, обладающие неплоским каркасным скелетом и сравнительно невысокой полярностью. Но если молекула Дон имеет сопряженный фрагмент, хотя и небольшой, но все-таки способный к π-π взаимодействиям (имеется ввиду С=С связь, сопряженная с С=О группой), а также 2 протонородных гидроксигруппы, то в случае Т-2 токсина, где нет элементов сопряжения и содержится всего одна гидроксигруппа, возможности к связыванию с сорбентом совсем мизерны.
Таким образом, низкая сорбция Т-2 токсина по сравнению с остальными 5-ю микотоксинами вполне объяснима его структурными особенностями.
Зеараленон и Фумонизин
В случае зеараленона и фумонизина результаты сорбции интерпретировать достаточно просто. Фумонизин содержит 4 карбоксильные группы, из которых 3 свободны от внутримолекулярного солеобразования. В кислой среде ионизация карбоксигрупп подавлена (схема 1), поэтому молекула фумонизина находится виде катиона или нейтрального цвиттер-иона и хорошо сорбируется. В слабощелочной среде при рН 7,3 эти 3 карбоксигруппы ионизируются, и в результате резко увеличивается гидрофильность молекулы, то есть сродство к водной фазе. Соответственно, Фумонизин хорошо сорбируется в кислой среде и плохо – в слабощелочной.
Схема 1.
Схема 1. Ионизация фумонизина в кислой и слабощелочной среде.
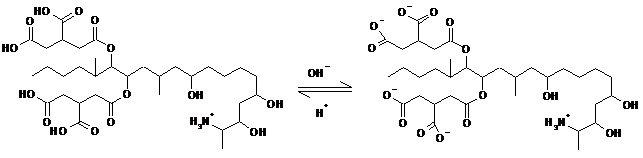
Фумонизин в кислой среде (рН 1.2) Фумонизин в слабощелочной среде (рН 7.3)
Аналогичная ситуация возникает в случае зеараленона. В кислой среде ионизация зеараленона подавлена (схема 2), что способствует его сорбции. В слабощелочной среде (рН 7,3) зеараленон ионизируется, хотя не полностью. Этого достаточно, чтобы резко понизилась сорбция при рН 7,3.
Схема 2.
Схема 2. Ионизация зеараленона в слабощелочной среде.
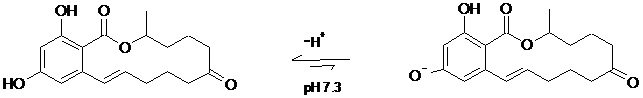
Нейтральная форма Ионизованная форма
Ранее мы показали (Животноводство России № ), что при переходе из кислой в слабощелочную среду в экспериментах на смеси корм-сорбент-токсин десорбция фумонизина и зеараленона не происходит. Дело в том, что если бы удерживание на смеси корм-сорбент было исключительно за счет неспецифической сорбции, то десорбция наверняка наблюдалась. Но как мы уже выше упоминали, удержание фумонизина и зеараленона на смеси обусловлено в значительной степени комплексообразованием. Если комплекс образоваля, то его разрушение требует значительной энергии (более 10 ккал/моль) и последующая смена рН раствора уже не изменяет связанное состояние токсина. Отсутствие десорбции явилось бы положительным фактором, если бы не очевидное разрушение корма в кишечнике под влиянием ферментов. В этом случае освободившиеся токсины, не имея возможности сорбции на сорбентах, попадут в русло крови и далее в печень.
Охратоксин
Схема 3. Ионизация охратоксина в слабощелочной среде.
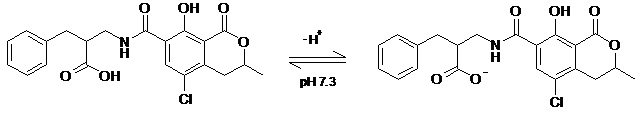
Нейтральная форма Ионизованная форма
Несколько сложнее обстоит дело с охратоксином. В кислой среде молекула охратоксина нейтральна, а в слабощелочной – ионизирована (схема 3). Нейтральная форма охратоксина менее гидрофильна и при прочих равных условиях должна была бы лучше сорбироваться из водного раствора. Но в ионизированной форме в молекуле возникают более сильные внутримолекулярные водородные связи, которые делают молекулу более плоской и усиливают донорно-акцепторное связывание с плоскими фрагментами сорбента.
Вторая тенденция, очевидно, играет более существенную роль, так как для шести сорбентов (см таб. 1-7) сорбция в слабощелочной среде сильнее, чем в кислой. Тем не менее, возможен и обратный эффект – так, на сорбенте 2 (таб. ) с алюмосиликатами сорбция в кислой среде сильнее, чем в слабощелочной, а на Фунгистате (1) сорбция в кислой и щелочной зонах практически одинакова. В какой-то степени это можно объяснить свойством алюмосиликатов, присутствующих в составе двух сорбентов, но более правдоподобно данная особенность объяснима присутствием каких-то липидных соединений в сорбентах. Скорее всего, именно липиды отвечают за сорбцию охратоксина в килой среде.
Афлатоксин В
Молекула афлатоксина нейтральна и ее форма не изменяется при смене рН раствора. Поэтому, различие в сорбирующей способности сорбентов по отношению к афлатоксину следует искать в самих сорбентах и их трансформациям под влиянием рН. Как видно из результатов, для семи сорбентов, содержащих те или иные органические субстанции (в т.ч различные полисахариды), сорбция в слабощелочной среде выше, чем в кислой. Для двух (3, 4 поз. Таб. 1),содержащих в рецептуре повышенные количества полисахаридов, сорбция в кислой среде вообще отсутствует. Можно предположить, что причиной этому является экранирование полисахаридных цепочек органических сорбентов в кислой среде, в том числе с участием ионной сольватации (катионами алюминия, кальция, меди и др.). Заметим, что в кислой среде данные ионы приобретают активность, в отличие от щелочной среды. В результате такой сольватации экранируются и дезактивируются центры органических сорбентов, отвечающие за сорбцию малополярных веществ, в частности, афлатоксина. Однако, и чисто алюмосиликатные сорбенты обладают весьма незначительной сорбцией афлатоксина, как в кислой, так и в слабощелочной зонах, поэтому ограничение сорбентов более предпочтительно. Исключением является «Фунгистат ГПК» (таб. 1), который имеет не доминирующую органическую часть (гепатопротекторный белок), однако основное – это наличие двух различных по природе сорбентов, обеспечивающих высокий уровень сорбции афлатоксина при различных рН.
ДОН.
Молекула ДОНа, как и в предыдущем случае нейтральна и ее форма не изменяется при смене рН раствора. Но в отличие от афлатоксина, ДОН содержит 2 гидроксильные группы и способен к образованию водородных связей с полярными кислородсодержащими группами. Например, (Х)Al=0 или (X2)Si=0. По данным таб. 4 связывание ДОНа происходит только в кислой среде, из чего можно заключить важность трансформации алюминий-кремниевых компонентов сорбента под влиянием кислоты. Вероятно, сорбция ДОНа в кислой среде возникает за счет перевода концевых гидроксигрупп в оксигруппы по реакции (Х)Al(OH)2+H+→(Х)Al=0+H2O. Данные табл.4 показывают, что молекула ДОН на всех изученных сорбентах связываются максимально до 47% и только в кислой области Рн. При этом наиболее эффективной является сорбция на алюмосиликатах, хуже на модифицированных и органических сорбентах. «Фунгистат» сорбирует 37% ДОН.
Т-2 токсин.
Приведенные выше рассуждения о сорбции ДОНа применимы также и для Т-2 токсина. Разница состоит в том, что Т-2 токсин еще менее полярен, чем ДОН и сорбируется еще хуже, сказать точнее вообще почти не сорбируется. Некоторая сорбция наблюдается на «Фунгистате», что скорее всего связано с наличием в нем двух сорбентов.
Причины плохой сорбции Т-2 токсина, связанные с его структурными особенностями, изложены выше. Вероятно, изученные сорбенты малопригодны для извлечения Т-2 токсина из водных сред. Полярные композиции вряд ли могут быть эффективны для этой цели. Необходим поиск других типов сорбентов.
Обсуждение результатов
Представленные ранее данные по сорбции в системе корм-сорбент-токсины показали, что сорбция токсинов на корм является определяющей, и сорбенты становятся малоконкурентными. Единственный выход – оперативное изменение концентрации сорбентов в соответствии с возникающей нагрузкой токсинами кормов и зерна. Здесь, однако, есть опасность такой эйфории, когда незначительные концентрации токсинов по нормам ниже МДУ, могут восприниматься некоторыми «cost-killers» (специалисты с задачей снижения себестоимости), как сигнал к полному изъятию нейтрализаторов токсинов из состава кормов. В конечном результате это приведет к хроническому токсикозу, а в случае проскока – к длительному гепатозу со всеми последствиями. В тоже время из вышеизложенных материалов следует, что сорбенты и в условиях отсутствия конкуренции обладают различной способностью к сорбции токсинов в кислой и слабощелочной зонах. Ряд токсинов, как мы видели вообще не обладают способностью к сорбции на любых сорбентах в слабощелочной зоне рН, и мы попытались объяснить эти наблюдения. Поиск сорбентов, обладающих каким-то унифицированным действием на токсины и в тоже время промышленно доступных, малоперспективен.
Таким образом, на практике мы имеем дело со смесью полисахаридов, липидов и белковых субстратов, в которых находятся выбранные нами, но часто недостаточно обоснованные концентрации сорбентов. Очевидно, что все эти субстраты будут деградировать в различных отделах кишечника микрофлорой. При этом большая часть токсинов будет высвобождена и поступит в русло крови, а затем в печень. В равной степени это относится к любым органическим сорбентам, если при этом не доказана необратимость сорбции. С учетом изложенного мы несколько лет назад, компануя рецептуру «Фунгистата», помимо двух неорганических сорбентов, образовали пул субстанций, усиливающих обменные процессы в гепатоцитах печени, с целью повышения ее детоксицирующей функции. Ранее было установлено (опыт invitro), что привентивное внесение «Фунгистата» в корм мышей, подготавливает печень к максимальной детоксикации. Это крайне важно для токсинов, которые не обладают способностью захватываться сорбентами (ДОН, Т-2 токсин). Совершенствование гепатопротекторного «пула» в составе нейтрализаторов – работа, которая должна быть продолжена. Возможно, что именно обогащение ряда нейтрализаторов субстанциями гепатопротекторного действия обеспечивает эффект in vivo (птица, свиньи), часто относимый за счет сорбентов, что не совсем корректно, на наш взгляд. И, наконец, следует сказать несколько слов о жидких сорбентах, одним из первых в этом направлении оказалась разработанная нами «Хитолоза». Этот жидкий нейтрализатор удачно дополняет «Фунгистат», поскольку быстро всасывается и осуществляет полную санацию от токсинов в системе корм-сорбент. «Хитолоза» - жидкий корм-сорбент, имеющий и энергетическую ценность, в настоящее время используется как быстродействующий сорбент при первых признаках отравления токсинами.











