Введение. Вирус гриппа вызывает острое респираторное заболевание у свиней и представляет интерес с точки зрения здравоохранения. У свиней было выделено большое количество подтипов вируса гриппа, и он продолжает развиваться. Нынешние тест-системы имеют ограниченный диапазон распознаваемых антигенов, в то время как для осуществления мониторинга и диагностики заболевания в стадах свиней необходим точный, высокочувствительный скрининг-тест широкого спектра. На данный момент для обнаружения в сыворотке свиней антител к вирусу гриппа был эвалюирован коммерческий блокирующий ИФА-тест разработанный для обнаружения антител к нуклеопротеину гриппа А у птиц. Для эвалюации метода использовались архивные образцы плазмы крови, используемые в исследованиях гриппа, проводимых Министерством сельского хозяйства США–Служба Сельскохозяйственных Исследований–Национальный Центр Болезней Животных, включая образцы от искусственно заражённых свиней (H1N1, H1N2, H2N3, и H3N2), естественно заражённых свиней, вакцинированных свиней и негативные контроли. Основой послужили образцы с известным статусом (n = 453), ROC-анализ результатов ИФА показал среднюю диагностическую чувствительность и специфичность 96.6% (95% доверительный интервал [CI]: 92.3, 98.9) и 99.3% (95% CI: 97.6, 99.9), соответствие. С учётом параметров, полученных при ROC-анализе, метод был эвалюирован для свиней, инфицированных двумя изолятами вируса H1N1 пандемии 2009. В целом метод показал себя превосходным диагностическим решением для обнаружения широкого спектра подтипов гриппа, и может быть использован в качестве скрининг-теста для свиней.
Хотите получить скидку 5 % на продукцию компании IDEXX?
Звоните по телефонам: +7 (800) 500 3585 или +7 (495) 120 7787 и назовите код скидки – ВЕРУМБИО321 PIG
Акция действительна до 31 июля 2021 года.
Введение
Вирус гриппа – это патоген, имеющий важность мирового значения с экономической, ветеринарной точки зрения и с точки зрения общественного здравоохранения. В популяциях свиней в Соединённых Штатах продолжительное время, по крайней мере последние 70 лет12, циркулировали вирусы Свиного Гриппа (SIV) подтипа H1N1. Помимо классического для свиней гриппа H1N1, в 1998 году был обнаружен тройной реассортантный (TR) вирус гриппа H3N2, который быстро распространился по свиным популяциям.10 С момента обнаружения TR H3N2 в 1998 преимущественно 3 подтипа вируса гриппа свиней циркулируют в популяциях свиней США: H1N1, H1N2 и H3N2. Вирусы H1N1 содержат гемагглютинин (HA) и нейраминидазу (NA) от классического свиного вируса и внутренние гены от тройного реассортантного вируса H3N2 (rH1N1); вирусы H1N2 содержат HA от классического свиного вируса, а NA и внутренние гены от тройного реассортантного вируса H3N2.8,20
Перемещение «кассеты» тройного реассортантного внутреннего гена (TRIG), привело, по-видимому, к увеличению уровня генетических изменений в изолятах североамериканского свиного гриппа подтипа H1 и развитию новых генетических и антигенных кластеров.19 В 2003 и 2004, в Канаде, у свиней были изолированы вирусы H1N1 и H1N2 с человеческим типом HA и NA.7 Эти вирусы были либо полностью человеческие, либо имели реассортантные внутренние гены классического свиного вируса. В дальнейшем реассортантные вирусы с человеческим HA и NA, но с кассетой тройных реассортантных внутренних генов (TRIG), были выделены у многих свиней в США.18 Этот схожий с человеческим вирус H1 стал эндемическим для популяций свиней США и конкурентно циркулирует одновременно с классическим вирусом гриппа свиней, он описывается как недавно открытый тип генетического и антигенного кластера вирусов свиного гриппа H1.18
Серологические анализы являются решающими для диагностики клинических заболеваний, для составления иммунного профиля стада, для определения времени вакцинации, мониторинга эффективности вакцинации и для эпидемиологических исследований с целью выявления доминирующего серотипа. Современные серологические исследования включают в себя реакцию торможения гемагглютинации (HI, РТГА), иммуноферментный анализ (ИФА) и реакцию вирус-нейтрализации (SVN, РВН). Но не смотря на то, что данные методы демонстрируют вполне удовлетворительные диагностические результаты в определении антител, гомологичных антигену в тест-системе, все они слабо применимы для обнаружения антител к гетерологичным вирусам гриппа. К тому же, проведение РТГА и РВН затруднено при использовании нестандартных биологических материалов и требует особой подготовки специалистов.
Появление в 2009 году человеческого пандемичного вируса гриппа А H1N1 с генами от свиного вируса4,6 выявило потребность в надёжном диагностическом экспресс-тесте для исследований и мониторинга зоонозных случаев в свиных популяциях во всём мире. Выполнение этой задачи требует от серологического анализа способности определять антитела к широкому спектру подтипов гриппа, включая недавно появившиеся в Северной Америке и Европе подтипы и реассортанты вируса свиного гриппа.1
Коммерческий ИФА тест-набор AI-MS ELISAa для диагностики гриппа птиц был разработан и валидирован для определения антител к различным видам данного возбудителя. В методе используются моноклональные антитела к человеческому вирусу гриппа А, подтип H1N121, которые узнают высококонсервативный эпитоп нуклеопротеина (NP) гриппа А. Целью данного исследования было приспособить тест-систему AI-MS ELISA для использования в диагностики свиной сыворотки. В исследовании использовалась сыворотка крови свиней, инфицированных в экспериментальных условиях подтипами H1N1, H1N2, H2N3 и H3N2.
Материалы и Методы
Схема эксперимента
На первой стадии диагностические характеристики тест-системы AI-MS ELISAa были эвалюированы с помощью 453 образцов, взятых из предыдущих исследований вируса гриппа, проводимых в Министерстве сельского хозяйства США–Служба Сельскохозяйственных Исследований–Национальный Центр Болезней Животных (USDA-ARS-NADC)9,15–19, и в некоторых других неопубликованных экспериментах. В число использованных сывороток входили 149 образцов от животных, специально заражённых вирусом гриппа А, подтипы H1N1, H1N2, H3N2 или H2N3, в 6 различных экспериментах, и 304 образца от животных отрицательного контроля (Таблица 1). Все образцы были протестированы с помощью тест-системы AI-MS ELISAa, результаты были эвалюированы с применением ROC-анализа.23 Кроме того были исследованы 104 образца от вакцинированных, неучтённых, животных с целью сравнения, но полученные данные не были включены в массив результатов, использованных для эвалюации метода.
На второй стадии с помощью AI-MS ELISAa были эвалюированны сыворотки от свиней, эксперементально заражённых двумя различным изолятами пандемичного вируса гриппа А H1N1 2009 года, с использованием предела положительных значений, установленного в 1 стадии. В число использованных сывороток вошли образцы от 40 свиней, взятые многократно в различные моменты времени до и после заражения.
Вирусы
Вирусы гриппа свиней были изолированы от животных павших во время вспышки респираторной инфекции и выращены на культуре клеток Мадин-Дарби почек собаки или в курином эмбрионе при помощи стандартных методов заражения или производства вакцины, как описано ранее.9,15–19 Для экспериментального заражения животных использовались следующие вирусы: A/SW/IA/15/1930 H1N1 (IA30), A/SW/MN/00194/2003 H1N2 (MN03), A/SW/IA/00239/2004 rH1N1 (IA04), A/SW/OH/511445/2007 H1N1 (OH07), A/SW/MN/07002083/07 huH1N1 (MN07), A/SW/MO/4296424/2006 H2N3 (MO06), A/SW/TX/4199-2/98 H3N2 (TX98), а также пандемичные вирусы гриппа A/CA/04/2009 H1N1 (CA09) и A/Mexico/4108/09 H1N1 (MX09). В исследования инактивированных вакцин вошли следующие вирусы: A/SW/MN/1192/2001 H1N2 (MN01), A/SW/NC36883/2002 rH1N1 (NC02), A/SW/KS/00246/2004 H1N2 (KS04), A/SW/IA/1945 H1N1 (IA45), A/SW/WI/1/1968 H1N1 (WI68), A/SW/IA/1973 H1N1 (IA73), A/SW/MN/37866/1999 H1N1 (MN99), A/SW/NC/02023/2008 H1N1 (NC08), A/SW/OH/02026/2008 H1N1 (OH08), A/SW/MO/02060/2008 H1N1 (MO08), A/SW/IA/02096/2008 H1N1 (IA08), A/SW/KY/02086/2008 H1N1 (KY08), A/SW/MN/02011/2008 H1N1 (MN08), A/SW/MN/02093/2008 H1N1 (MN08-2), A/SW/MN/02053/2008 huH1N1 (MN08-3), A/SW/NE/02013/2008 H1N1 (NE08), A/SW/NC/02084/2008 H1N1 (NC08), A/SW/TX/01976/2008 H1N2 (TX08) и A/SW/IA/02039/2008 huH1N1 (IA08-hu).
Животные, методы постановки и образцы сыворотки
Из стада, свободного от гриппа свиней и вируса репродуктивно-респираторного синдрома свиней (PRRSV), были отобраны четырёхнедельные свиньи различных пород. Животные были сгруппированы в индивидуальные изолированные помещения, уход производился в соответствии с нормами Комитета по Биоэтике Национального Центра Заболеваний Животных. В начале акклиматизационного периода всем свиньям был назначен Цефтиофур (ceftiofur crystalline-free acid)b. Перед инокуляцией или вакцинацией вирус свиного гриппа не был обнаружен в назальных смывах, и в РТГА с сывороткой крови не были обнаружены антитела против гриппа. Таким образом, все животные считались свободными от вируса гриппа свиней.
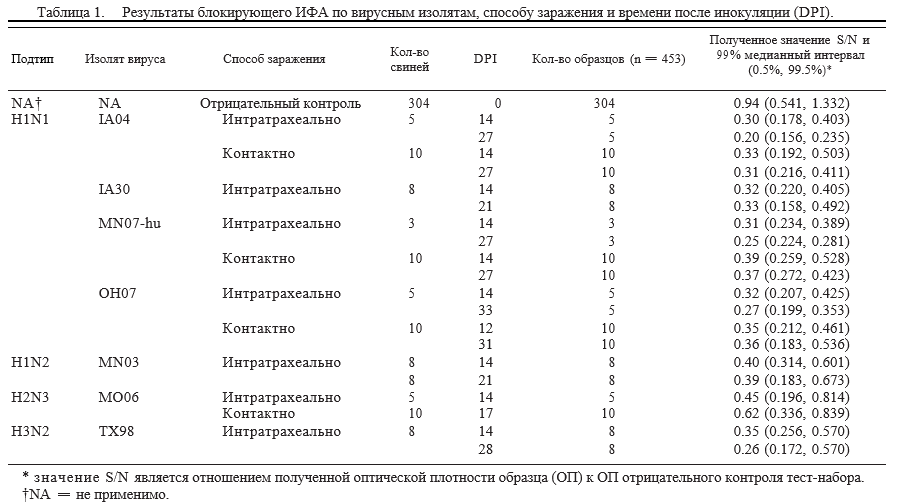
Суммарно на первой стадии исследований для эвалюации тест-системы AI-MS ELISAa были доступны 453 образца сыворотки (Таблица 1, 2). В число образцов входили 304 образца сыворотки от 304 грипп-отрицательных контрольных животных и 149 образцов сыворотки от 84 грипп-инфицированных животных. Экспериментально инфицируемые животные (n=44) получали 2 мл вируса гриппа в концентрации приблизительно 1х105 [полуинфицирующей культуру ткани дозы (TCID50)]/мл интратрахеально под анастезией, как описано ранее.9,15–19 Оставшиеся 40 грипп-инфицированных свиней были заражены посредствам контакта с интратрахеально инокулированными животными, начиная со 2 или 3 дня после инокуляции. Подтипы гриппа, изоляты, тип заражения (интратрахеальный или контактный), количество свиней дни отбора сыворотки указаны в Таблице 1.
Образцы сыворотки (n=104) от грипп-вакцинированных животных, не принимавших участия в эксперименте, были проанализированы, но не включены в общий ROC-анализ, с помощью которого установлены предельные оценочные значения для тест-системы AI-MS ELISAa. Вакцинированные свиньи получали внутримышечную инъекцию вируса гриппа, инактивированную ультрафиолетом, комбинированную с коммерческим адъювантомc, в концентрации 1х106 TCID50/мл, или приблизительно 64–128 ГАЕ (гемагглютинирующая единица), и дозу антигена 2–3 недели спустя. Сыворотка была отобрана после инициирующей дозы (примерно через 14 дней после вакцинации) и ещё раз после усиливающей дозы (примерно через 28 дней после инициирующей вакцинации). Изоляты вакцины, количество свиней и дни отбора сыворотки указаны в Таблице 2.


На стадии 2, чтобы эвалюировать характеристики набора AI-MS ELISAa с использованием сывороток, полученных от свиней инфицированных пандемичным H1N1 2009, в анализе использовали оценочные значения, полученные при исследовании сывороток на стадии 1. Экспериментально инфицированные животные (n=40) получали по 2 мл пандемичного вируса гриппа в концентрации приблизительно 1х105 TCID50/мл интратрахеально, как описано выше. У подгрупп свиней впоследствии отбиралась сыворотка на 0, 3, 5, 7, 14 и 21 день после инфицирования.
Методы
Реакция торможения гемагглютинации. Сыворотка была инактивирована нагреванием до 56°C и избавлена от неспецифических гемагглютинирующих агентов добавлением 20% суспензии каолинаd и последующей адсорбцией с 0.5% раствором красных кровяных телец индейки (ККТ). РТГА выполнялась с ККТ индейки при помощи гомологичного вируса и антисыворотки по стандартной технике постановки (WHO Manual on Animal Influenza Diagnosis and Surveillance, http://www.wpro.who.int/NR/rdonlyres/EFD2B9A7-2265-4AD0-BC98-97937B4FA83C/0/manualonanimalaidiagnosi....
AI-MS ELISA. Тест-система AI-MS ELISAa лицензирована на определение антител к гриппу птиц в образцах сыворотки крови кур, индейки, уток, страусов и гусей. Образцы были происследованы в дубле, в соответствие с инструкцией производителя по тестированию сыворотки крови птиц, с использованием 15 мл сыворотки крови свиней разведённой 10-кратно в дилюенте, поставляемом производителем. Разбавленная сыворотка была перенесена в лунки, покрытые иммобилизованным вирусным нуклеопротеином (НП), и оставлена на определённое время для связывания с антигеном. Анти-НП антитела, конъюгированные с пероксидазой хрена (HRP), в сочетании с последующим добавлением субстрата (3,3’,5,5’-тетраметил бензидина (TMB)), были использованы в качестве цветового индикатора. В случае, если в пробе присутствуют антитела, они конкурентно связываются с эпитопом и блокируют его для связи с конъюгатом. Интенсивность окраски реакции, обратно-пропорциональную количеству антител к вирусу гриппа в образце, измерялась с помощью ИФА-ридераe при длине волны 650 нм. Учёт полученных данных и расчёты производились при помощи программного обеспечения, предоставляемого производителем тест-системы.a Результатом является отношение полученной оптической плотности образца (ОП) к полученной ОП отрицательного контроля тест-набора (S/N).
Анализ
Описывающие статистические данные были получены при помощи статистической программы JMP (версия 7.0.2)f на стадии 1. Схема эксперимента исключила возможность проведения полного факторного анализа методом дисперсионного анализа (ANOVAg) на уровне изолята, подтипа, контрольных групп или дня после инокуляции (DPI), потому что данные не были сбалансированы в соответствии с факторами, и многие комбинации факторов предполагали различные итоговые данные. Поэтому дисперсионный анализ проводился только на уровне контрольных групп (интратрахеальное заражение, контактное заражение, вакцинированные и неучтённые). Анализ полученных рабочих данных проводился для каждой контрольной группы при помощи MedCalc, версия 10.4.0.0.h В каждом ROC-анализе значение грипп-отрицательной пробы составлялось из значений S/N, полученных для каждого из 304 животных отрицательного контроля. Из-за небольшого количества животных на стадии 2 ROC-анализ не составлялся. Поэтому были получены описывающие статистические данные с медианой 99-процентиль, и предельные положительные значения были рассчитаны из ROC-анализа стадии 1.
Результаты
На стадии 1 сыворотка от заведомо позитивных животных, как было предварительно подтверждено с помощью РТГА, была использована в ИФАa. Значения S/N и средние 99%-ные интервалы (0.5%, 99.5%) для инфицированных и вакцинированных свиней указаны в таблице 1 и 2 соответственно.

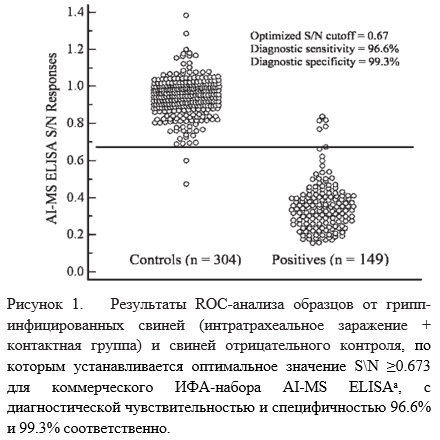
Чтобы сгруппировать разбросанные точки данных в пределах некоторых комбинаций факторов, распределение результатов было представлено как средний 99%-й интервал. Рассчитанные значения S/N и области под ROC-кривой (ROC AUC), а так же оптимизированные в соответствии по диагностической специфичностью и чувствительностью предельные значения S/N представлены в Таблице 3. Дисперсионный анализ показал статистически значимые различия в значениях S/N для интратрахеально заражённых, контактно заражённых и неучтённой группы вакцинированных животных. Однако ROC-анализ не выявил значительной разницы между группами интратрахеального и контактного заражения. С помощью ROC-анализа, основанного на 149 образцах от грипп-инфицированных свиней (интратрахеальное заражение + контактные группы) и 304 свиньях отрицательного контроля, для тест-системы AI-MS ELISA было получено оптимизированное предельное значение S/N положительных образцов ≥0.673 с соответствующими диагностическими чувствительностью и специфичностью в 96.6% (95%-й доверительный интервал [CI]: 92.3, 98.9) и 99.3% (95%CI: 97.6, 99.9), соответственно (Таблица 4, Рис. 1).

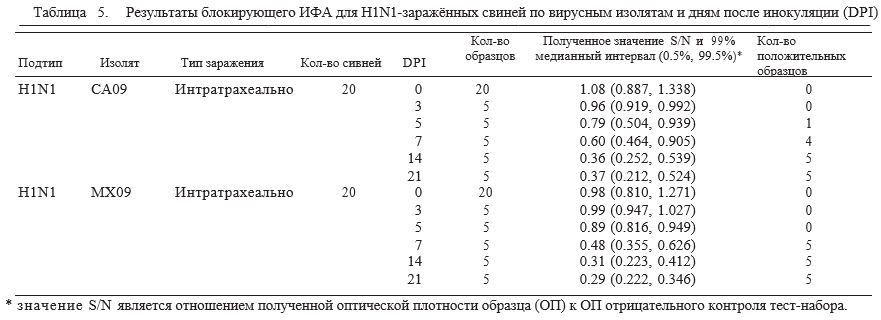
В исследовании 2, при помощи сокращения 0.673 установленных выше, сероконверсия у свиней, заражённых пандемичным гриппом H1N1 2009 года, была обнаружена у одной свиньи уже на 5 день после заражения (DPI) и у 9 из 10 свиней на 7 день после заражения. На 14 день после заражения у всех свиней, экспериментально зараженных CA09 или MX09, значения S/N оказались ниже предельного значения положительного образца. Значения S/N для свиней, зараженных пандемичным H1N1, представлены в Таблице 5.
Обсуждения
Тест-система AI-MS ELISAa, использованная в данном исследовании, является эпитоп-блокирующим анализом, в котором меченные моноклональные антитела к нуклеопротеину гриппа А блокируются для связывания с НП гриппа птиц, иммобилизованным на микропланшете, в случае присутствия в пробе антител к НП. Моноклональные антитела, использованные в тест-системе, были получены при помощи человеческого вируса гриппа А, подтипа H1N121, и распознают высококонсервативный эпитоп нуклеопротеина вируса гриппа А. Данный формат анализа не требует использовать какие-либо видоспецифичные реагенты, так как в основе анализа лежит способность антител образца связывать и блокировать иммобилизованные на микропланшете иммунодоминантные эпитопы нуклеопротеина вируса гриппа птиц. Это делает данную тест-систему широко применимой для различных видов животных, вырабатывающих антитела, узнающие НП вируса гриппа А.
Эпитоп-блокирующий анализ является предпочтительным диагностическим методом в том случае, если патоген имеет широкую многовидовую заражающую способность, при этом найден консервативный иммунодоминантный эпитоп и доступные комплиментарные моноклональные антитела. Например, был разработан и эвалюирован многовидовой блокирующий тест для определения антител к вирусу Ящура3, вирусу лихорадки Западного Нила2, подтипу C пневмовируса птиц14 и вирусу везикулярного стоматита. Большинство многовидовых блокирующих тестов для диагностики гриппа А, описанных в литературе, в основе метода имеют обнаружение нуклеопептида.5,11,13,22 В предыдущих исследованиях5 формат блокирующего ИФА был успешно применён для обнаружения анти-НП антител у людей, хорьков, свиней, лошадей, кур, уток, морских свинок, мышей и тюленей.
Нужно сказать, что это первое из описанных исследований, в котором ИФА-набор, разработанный и лицензированный для определения гриппа в сыворотке крови птиц, использован для обнаружения антител к вирусному НП в сыворотке крови свиней, инфицированных или вакцинированных Североамериканскими вирусами гриппа. Тест-система AI-MS ELISAa показала отличные результаты, определив антитела к гриппу, выработанные свиньями после заражения, всех протестированных изолятов вируса начиная с 5 дня после заражения (срок первого отбора проб крови). В отличие от рекомендованного производителем предельного значения S/N=0,500 для птичей сыворотки, ROC-анализ результатов от данного набора образцов выявил оптимальное предельное значение S/N для образцов свиных сывороток равное 0,673. Так как формат ИФА блокирующий, образцы с показателем ≤0.673 будут считаться положительными, а >0.673 - отрицательными.
Образцы сывороток свиней, привитых вакциной с цельными вирионами, демонстрируют показатели S/N в положительном диапазоне, часто уже после первой дозы (14 дней после вакцинации) и ещё более достоверно после дополнительной дозы антигена (28 дней после вакцинации). Замедленный иммунный ответ вакцинированных животных на нуклеопротеин вероятен, потому что по сравнению с естественным процессом репликации в организме-хозяине, в инактивированной вакцине количество НП ограниченно и значительно меньше. Тем не менее полученные данные говорят о том, что метод вполне применим для мониторинга реакции на вакцину и контроля за правильностью вакцинирования в хозяйствах. Ко всему прочему у метода есть потенциальная возможность дифференцировать заражённых и вакцинированных животных в том случае, если использовалась субъединичная вакцина или вакцина с частями вирионов без нуклеопротеина. В дальнейшем потенциальная область исследований применения данного набора связана с мониторингом времени распада материнских антител у поросят для установления точного времени вакцинации.
Недавнее появление в 2009 году пандемичного вируса гриппа человека H1N14,6 привело к всеобщему осознанию необходимости повышенного внимания к свиным популяциям. Данное исследование демонстрирует способность тест-системы AI-MS ELISA быстро определять антитела к вирусу гриппа, как против эндемичного Североамериканского гриппа свиней, так и против пандемичного H1N1. Эта тест-система может быть зарегистрирована в качестве официального инструмента для диагностирования и мониторинга вспышек заражения вирусом H1N1 или другими вирусами гриппа А. AI-MS ELISAa представляет из себя тест-набор из стандартизованных реагентов, в формате, доступном для постановки и учёта результатов в большинстве ветеринарных лабораторий по всему миру. Если мыслить шире, повсеместное применение данного метода могло бы привести к владению более точными, подробными и универсальными серологическими данными по вирусу гриппа в глобальном масштабе.
Для того, чтобы точно определить пределы диагностических возможностей данного метода, необходимо провести дополнительные исследования.
Благодарности
Авторы благодарят Мишель Харланд (Michelle Harland) и Хилари Хорст (Hillary Horst) за техническую поддержку, доктора Пабло Лопес (Dr. Pablo Lopez) из IDEXX Laboratories Inc. за комментарии и предложения, и за предоставление ИФА-наборов; доктора Мари Грамер (Dr. Marie Gramer) (Университет Миннесоты), доктора Александра Климова (Dr. Alexander Klimov) (CDC) за предоставленные изоляты гриппа А и доктора Рэя Уотерса (Dr. Ray Waters) (USDA-ARSNational Animal Disease Center) за непредвзятый обзор рукописи. Упоминание торговых марок или коммерческих продуктов в этой статье обусловлено исключительно необходимостью предоставления определенной информации и не подразумевает рекомендацию или одобрение американским Министерством сельского хозяйства.
Поставщики и производители
a. FlockChek® Avian Influenza MultiS-Screen Antibody Test Kit, IDEXX Laboratories Inc., Westbrook, ME.
b. Pfizer Animal Health, New York, NY.
c. Emulsigen, MVP Laboratories Inc., Ralston, NE.
d. Sigma-Aldrich, St. Louis, MO.
e. Molecular Devices Corp., Sunnyvale, CA.
f. SAS Institute Inc., Cary, NC.
g. OriginLab, Northampton, MA.
h. MedCalc Software, Mariakerke, Belgium.
Литература
1. Barbe F, Labarque G, Pensaert M, Van Reeth K: 2009, Performance of a commercial Swine influenza virus H1N1 and H3N2 antibody enzyme-linked immunosorbent assay in pigs experimentally infected with European influenza viruses. J Vet Diagn Invest 21:88–96.
2. Blitvich BJ, Marlenee NL, Hall RA, et al.: 2003, Epitopeblocking enzyme-linked immunosorbent assays for the detection of serum antibodies to West Nile virus in multiple avian species. J Clin Microbiol 41:1041–1047.
3. Chenard G, Miedema K, Moonen P, et al.: 2003, A solidphase blocking ELISA for detection of type O foot-andmouth disease virus antibodies suitable for mass serology. J Virol Methods 107:89–98.
4. Dawood FS, Jain S, Finelli L, et al.: 2009, Emergence of a novel swine-origin influenza A (H1N1) virus in humans. N Engl J Med 360:2605–2615.
5. de Boer GF, Back W, Osterhaus AD: 1990, An ELISA for detection of antibodies against influenza A nucleoprotein in humans and various animal species. Arch Virol 115:47–61.
6. Garten RJ, Davis CT, Russell CA, et al.: 2009, Antigenic and genetic characteristics of swine-origin 2009 A(H1N1) influenza viruses circulating in humans. Science 325:197–201.
7. Karasin AI, Carman S, Olsen CW: 2006, Identification of human H1N2 and human-swine reassortant H1N2 and H1N1 influenza A viruses among pigs in Ontario, Canada (2003 to 2005). J Clin Microbiol 44:1123–1126.
8. Karasin AI, Landgraf J, Swenson S, et al.: 2002, Geneticcharacterization of H1N2 influenzaA viruses isolated from pigs throughout the United States. J Clin Microbiol 40:1073–1079.
9. Ma W, Vincent AL, Gramer MR, et al.: 2007, Identification of H2N3 influenza A viruses from swine in the United States. Proc Natl Acad Sci U S A 104:20949–20954.
10. Olsen CW, Carey S, Hinshaw L, Karasin AI: 2000, Virologic and serologic surveillance for human, swine and avian influenza virus infections among pigs in the north-central United States. Arch Virol 145:1399–1419.
11. Shafer AL, Katz JB, Eernisse KA: 1998, Development and validation of a competitive enzyme-linked immunosorbent assay for detection of type A influenza antibodies in avian sera. Avian Dis 42:28–34.
12. Sheerar MG, Easterday BC, Hinshaw VS: 1989, Antigenic conservation of H1N1 swine influenza viruses. J Gen Virol 70:3297–3303.
13. Starick E, Werner O, Schirrmeier H, et al.: 2006, Establishment of a competitive ELISA (cELISA) system for the detection of influenza A virus nucleoprotein antibodies and its application to field sera from different species. J Vet Med B Infect Dis Vet Public Health 53:370–375.
14. Turpin EA, Lauer DC, Swayne DE: 2003, Development and evaluation of a blocking enzyme-linked immunosorbent assay for detection of avian metapneumovirus type C-specific antibodies in multiple domestic avian species. J Clin Microbiol 41:3579–3583.
15. Vincent AL, Lager KM, Janke BH, et al.: 2008, Failure of protection and enhanced pneumonia with a US H1N2 swine influenza virus in pigs vaccinated with an inactivated classical swine H1N1 vaccine. Vet Microbiol 126:310–323.
16. Vincent AL, Lager KM, Ma W, et al.: 2006, Evaluation of hemagglutinin subtype 1 swine influenza viruses from the United States. Vet Microbiol 118:212–222.
17. Vincent AL, Ma W, Lager KM, et al.: 2007, Efficacy of intranasal administration of a truncated NS1 modified live influenza virus vaccine in swine. Vaccine 25:7999–8009.
18. Vincent AL, Ma W, Lager KM, et al.: 2009, Characterization of a newly emerged genetic cluster of H1N1 and H1N2 swine influenza virus in the United States. Virus Genes. Epub ahead of print.
19. Vincent AL, Swenson SL, Lager KM, et al.: 2009, Characterization of an influenza A virus isolated from pigs during an outbreak of respiratory disease in swine and people during a county fair in the United States. Vet Microbiol 137: 51–59.
20. Webby RJ, Rossow K, Erickson G, et al.: 2004, Multiple lineages of antigenically and genetically diverse influenza A virus co-circulate in the United States swine population. Virus Res 103:67–73.
21. Yewdell JW, Frank E, Gerhard W: 1981, Expression of influenza A virus internal antigens on the surface of infected P815 cells. J Immunol 126:1814–1819.
22. Zhou EM, Chan M, Heckert RA, et al.: 1998, Evaluation of a competitive ELISA for detection of antibodies against avian influenza virus nucleoprotein. Avian Dis 42:517–522.
23. Zweig MH, Campbell G: 1993, Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem 39:561–577.